
Извлечение минералов из морской воды
Несмотря на то что ныне известно не менее 60 растворенных в морской воде элементов, в промышленных масштабах извлекается всего лишь четыре. Это натрий, хлор (обычная поваренная соль), магний и некоторые его соединения, а также бром. В качестве побочных отходов в процессе получения поваренной соли или при извлечении магния добывают некоторые соединения кальция и калия. Обычно эти продукты получают либо в результате экстракции из морской воды, либо при переработке водорослей, концентрирующих кальций и калий. Следует, однако, отметить, что промышленное извлечение перечисленных элементов непосредственно из морской воды все еще не освоено. Предпринимались многочисленные попытки экстрагировать другие минеральные соединения из морской воды, однако промышленная добыча оказалась безуспешной. Запатентовано также немало способов извлечения из морской воды поваренной соли, магния и его соединений, брома, йода, калия, сульфата кальция, золота и серебра (Baudin, 1916; Cernik, 1926; Niccali, 1925; S. О. Petterson, 1928; Vienne, 1949).
Извлечение поваренной соли
Систематическое получение соли из морской воды было начато в Китае намного раньше 2200 г. до н. э. Веками многие народы были зависимы от моря как источника соли (Armstrong, Miall,1946). И сейчас соль, добываемая из морской воды простым выпариванием солнечными лучами, занимает значительную долю в общем балансе потребления соли такими странами, как Китай, Индия, Япония, Турция и Филиппины. Ежегодно во всем мире производится около 6 млн. т соли. Как правило, для производства соли выпариванием из морской воды необходим жаркий климат с сухими ветрами. Однако помимо близости моря и жаркого климата требуется соблюдение еще ряда условий: слабая водопроницаемость грунта испарительных бассейнов, наличие обширных низменных площадей, лежащих ниже уровня моря или затопляемых морскими приливами, малое количество осадков в течение месяцев активного испарения, отсутствие разбавляющего влияния речных пресных вод и, наконец, в связи с низкой стоимостью добычи соли - наличие дешевых транспортных средств либо близость рынков сбыта.
Рис. 5. Искусственные бассейны для выпаривания соли под воздействием солнечных лучей близ южного окончания залива Сан-Франциско (Калифорния). В центре фотографии видна конусообразная насыпь, сложенная из добытой соли.
Около 5% всей соли, потребляемой Соединенными Штатами, производится испарением, преимущественно в районе залива Сан-Франциско, где этот промысел был начат еще в 1852 г. На рис. 5 показаны искусственные испарительные бассейны близ южной конечности залива Сан-Франциско. Здесь с общей площади около 80 кв. миль "Лесли салт компани" ежегодно добывает примерно 1,2 млн. т соли. Аналогичные соляные промыслы находятся также в верховьях заливов Ньюпорт и Сан-Диего в Южной Калифорнии; их годовая производительность составляет 100 тыс. т (Emery, 1960). Пуск морской воды в испарительные бассейны близ залива Сан-Франциско осуществляется в период полной воды через шлюзные ворота в дамбе, ограждающей бассейн от моря. Морская вода выдерживается здесь до тех пор, пока значительная ее часть не испарится и не наступит садка заключенных в ней солей.

Рис. 6. Механические скреперы используются для снятия верхнего слоя закристаллизовавшейся соли. К моменту 'уборки соляного урожая' мощность слоя соли обычно достигает 4-6 дюймов.
Сульфат кальция кристаллизуется из раствора одним из первых. После осаждения на дно солей сульфата кальция оставшаяся рапа осторожно переводится в садочный бассейн, где вследствие испарения происходит дальнейшее сгущение раствора до начала осаждения хлорида натрия. Выпаривание рапы продолжается до момента достижения ею удельного веса около 1,28, то есть до начала садки солей магния. На этом этапе соляной раствор носит название горького маточного рассола. Рассол извлекают из садочного бассейна и переправляют на другие предприятия, где из него получают различные соединения магния, бром и другие соли. После удаления рассола в садочный бассейн вновь заливают свежую рапу и весь цикл получения хлорида натрия повторяется. К 1 августа на дне таких бассейнов накапливается слой хлорида натрия толщиной 4-6 дюймов. Выборка соли производится при помощи механических скреперов и погрузчиков (рис. 6); затем соль отмывается от различных примесей морской водой и складируется в виде больших конусообразных насыпей (рис. 7). Соль, идущая для промышленного использования, в большинстве случаев не подвергается дальнейшей очистке. Однако ее дополнительно очищают, если она предназначается для пищевого потребления населением. Содержание NaCl в рафинированном продукте превышает 99,9%. Стоимость соли, полученной путем свободного испарения морской воды под воздействием солнца, колеблется в США от 10 долл. за 1 т сырого продукта близ места добычи до 150 долл. за 1 т очищенной и расфасованной поваренной соли.

Рис. 7. Конусообразная насыпь, сложенная из соли, добытой в искусственных испарительных бассейнах, залив Сан-Франциско. В подавляющем большинстве случаев дальнейшее промышленно-хозяйственное использование добытой и промытой соли не связано с дополнительным рафинированием.
Схема добычи соли из морской воды примерно одинакова во всем мире, тем не менее в ряде стран дешевая рабочая сила позволяет видоизменять этот процесс.
В странах иного климата, например в Швеции и в Советском Союзе, соль получают путем вымораживания морской воды. Рассольный лед, состоящий из почти чистой воды, отфильтровывается от остаточного рассола, на котором затем производится ряд последовательных операций по его вымораживанию, прежде чем концентрация остаточных его порций станет достаточно высокой, чтобы начать выпаривание досуха под действием искусственного нагрева (Armstrong, Miall, 1946).
Концентрированная рапа, оставшаяся после отделения хлорида натрия, подвергается дальнейшей специальной обработке с целью извлечения имеющихся в них соединений. Так, добавление в раствор хлорида кальция вызывает садку сульфата кальция (гипса), который затем поступает в продажу. При дальнейшем концентрировании рассола в осадок выпадают сульфаты магния, калия и другие соли. В заключительных стадиях процесса из остаточного раствора извлекается хлорид магния и бром.
Экстракция брома из морской воды
Бром можно рассматривать как почти морской элемент, поскольку в океане находится 99% всего содержания брома в земной коре (см. табл. 2). Бром был открыт в 1825 г. французским исследователем А. Ж. Балардом в концентрированных растворах, полученных после осаждения соли из воды соленых маршей близ Монпеллье. Позднее бром был обнаружен в составе калийных залежей Страсфурта и в рассолах из буровых скважин Мичигана, Огайо и Западной Виргинии. Из морской воды бром был впервые выделен в 1926 г. в Калифорнии при обработке маточных рассолов, получаемых в процессе извлечения соли в искусственных испарительных бассейнах. Потребление брома промышленностью было сравнительно ограниченным до начала производства высококомпрессионных двигателей внутреннего сгорания, так что спрос рынка удовлетворялся теми количествами, которые добывались из скважинных рассолов и соляных залежей. Но затем положение резко изменилось. В бензин с антидетонационными свойствами, содержащий присадку тетраэтилсвинца, стали добавлять этилендибромид, чтобы предотвратить отложение свинца на стенках цилиндров, клапанах, поршнях и на свечах. При столь возросших потребностях в броме рассолов, выкачиваемых из буровых скважин, оказалось недостаточно. Не удовлетворяла спрос и добыча брома как побочного продукта при производстве соли. Возникла острая необходимость в ином источнике брома.
В ходе широких поисков дополнительных источников брома "Этил корпорейшн" разработала процесс прямого осаждения брома непосредственно из морской воды, которая не подвергалась предварительному концентрированию. Согласно этой схеме бром осаждается в виде нерастворимого соединения - триброманилина - при обработке морской воды анилином и хлором. Во избежание гидролиза хлора морская вода предварительно подкисляется серной кислотой. Позднее этот процесс расширили до масштабов промышленного производства. Установка была смонтирована на судне, которое затем было переоборудовано в завод по извлечению брома. Работая 25 дней в месяц, такой плавучий завод производит около 75 тыс. фунтов брома. За этот же срок заводом потребляется реагентов: 250 т концентрированной серной кислоты, 25 т анилина, 66 т хлора, хранимых между верхней и нижней палубами. Эффективность извлечения брома из морской воды, где его содержится всего 0,1 фунта на 1 т, равна примерно 70%. На судне предусмотрены защитные меры, предпринимаемые для того, чтобы избежать разбавления морской воды отработанными водами, сливаемыми после завершения технологического процесса. Позднее было установлено, что для предотвращения смешения можно с успехом использовать вдольбереговые морские течения, существующие у многих побережий. В настоящий момент считают, что с технической точки зрения процесс извлечения брома на борту плавучего завода решен успешно, однако работа в открытом море с весьма коррозионно-активными реагентами гораздо сложнее, чем на суше.
Выбор места для постройки завода по извлечению брома следует производить с особой тщательностью. При этом необходимо заранее исключить возможности разбавления потребляемых заводом морских вод дождевыми осадками, сточными водами, а также водами, из которых бром уже извлечен. Кроме того, морская вода должна иметь высокую и постоянную соленость, относительно высокую температуру и не должна быть загрязнена органическими отбросами, на которые бесполезно расходуется хлор. Такое место, удовлетворяющее всем перечисленным требованиям, было найдено близ Кьюр-Бич (Северная Каролина). Здесь "Этил дау кемикл компани" построила завод производительностью 3 тыс. т брома в год. В 1938 г. мощность этого предприятия была увеличена до 20 тыс. т брома в год (Shigley, 1951).
Другой завод подобного типа построен близ Фрипорта, где условия для извлечения брома из морской воды в большей мере отвечают всем технологическим требованиям, чем около Кьюр-Бича. Проектная мощность этого завода 15 тыс. т брома в год. В 1943 г. там же был сооружен еще один завод равной мощности. Предприятие же близ Кьюр-Бича в конце второй мировой войны было закрыто. Таким образом, заводы Фрипорта производят в настоящее время около 80% потребляемых за год Соединенными Штатами количеств брома. На рис. 8 приводится схема технологического процесса извлечения брома "Этил дау кемикл компани".
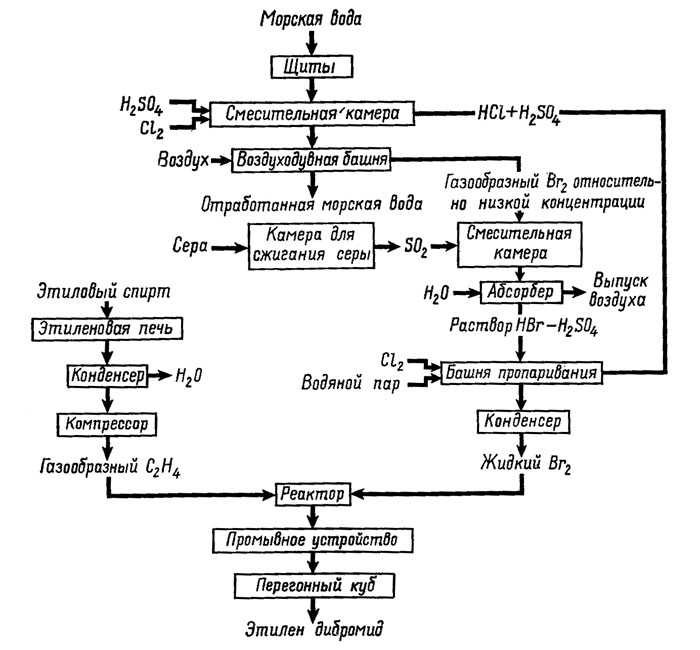
Рис. 8. Схема технологического процесса извлечения брома из морской воды по Шигли (Shigley, 1951).
На заводе Кьюр-Бича, согласно ранее разработанной технологии, смесь морской воды с кислотой и хлором заливалась в верхнюю часть кирпичной башни с встроенными внутри нее деревянными решетками. Растворенный в морской воде бром восстанавливался хлором до относительно летучего элементарного брома, а присутствующая в смеси кислота препятствовала гидролизу хлора. По мере того как смесь морской воды с бромом стекала из верхних частей башни, производилась продувка воздуха снизу вверх. Проходящий воздух выносил свободный бром из морской воды и переносил его в абсорбционную башню, заполненную кальцинированной содой, после чего уже не содержащая брома морская вода сливалась обратно в море. Насыщенный бромом раствор кальцинированной соды обрабатывался серной кислотой с целью перевода броматов и бромидов натрия в свободный бром. Затем смесь закачивалась в испарительную колонку, где производилась отгонка и вторичная конденсация брома в стеклянные или керамические сосуды. Дальнейшая очистка брома путем дистилляции позволяла получать в конечном итоге продукт с содержанием брома до 99,7%.
В 1937 г. этот процесс был несколько модифицирован. Так, при первичной отгонке брома в качестве переносящих агентов использовались сернистый ангидрид и воздух. В результате бром высвобождался в форме бромистоводородной кислоты, что позволяло существенно улучшить его последующую очистку. И хотя эффективность извлечения брома в обоих процессах превышает 90%, в настоящее время в США почти исключительно применяется процесс прямой экстракции брома из морской воды с использованием сернистого ангидрида (Shigley, 1951).
Извлечение магния из морской воды
Магний является самым легким из применяющихся в строительстве металлов. Его удельный вес 1,74, тогда как у алюминия он равен 2,70, а у железа - 7,87. Наиболее широкое применение этот металл, находит в строительстве транспортных средств. Кроме того магний используется как компонент сплавов с алюминием, в системах анодных и катодных защитных покрытий, в импульсных фотолампах и во многих других областях техники. К 1964 г. ежегодное мировое производство магния составляло около 150 тыс. т.
В морской воде содержится примерно 0,13% магния. И несмотря на то что такая концентрация составляет всего лишь 1/300 того количества, которое содержится в магниевой руде, добываемой на суше, для Соединенных Штатов главным источником этого металла является морская вода. Впервые магний был получен из морской воды в Англии (Armstrong, Miall, 1946), однако первое крупное предприятие по извлечению магния из морской воды было сооружено близ Фрипорта в начале 1941 г. "Этил дау кемикл компани". До этого времени магний в США получали из скважинных рассолов и из магнезитовых месторождений.
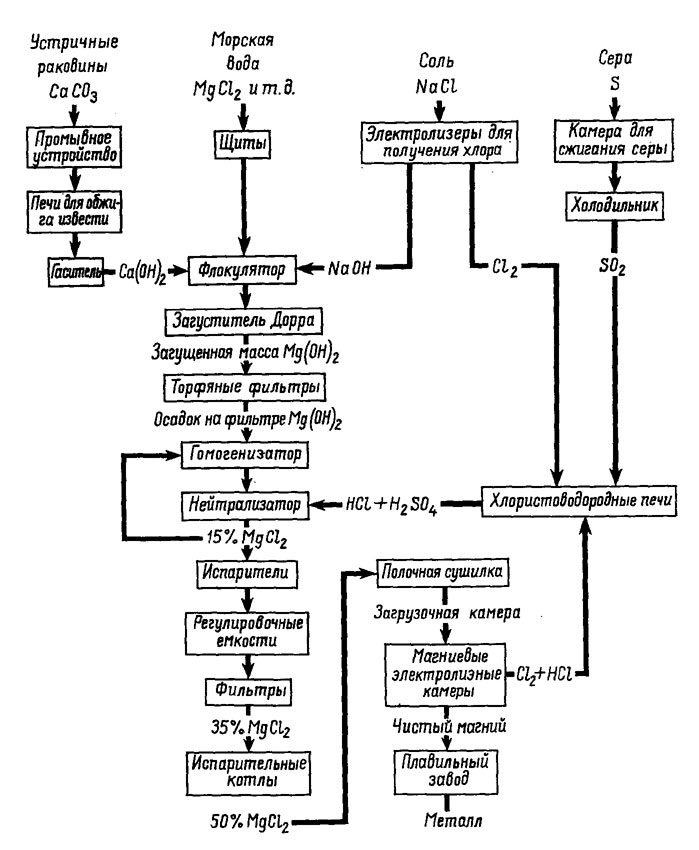
Рис. 9. Схема технологического процесса извлечения магния из морской воды по Шигли (Shigley, 1951).
Выбор места для постройки завода близ Фрипорта был продиктован следующими весьма благоприятными обстоятельствами. Наличие дешевого природного газа позволяет эффективно его использовать для получения тепла и электроэнергии. Географическое местоположение завода дает возможность сливать сточные, отработанные воды обратно в Мексиканский залив, с крайне ничтожной возможностью разбавления ими потребляемых морских вод. Очень дешевую известь можно получать из известковых раковин, добываемых со дна Мексиканского залива, всего в нескольких милях от магниевого завода. На рис. 9 показана технологическая схема извлечения магния на заводе близ Фрипорта, а один из участков этого завода изображен на рис. 10.

Рис. 10. Общий вид магнийперерабатывающей установки на заводе 'Этил дау кемикл компани', Фрипорт (Тexac). На переднем плане видны загустители Дорра, в которые смесь морская вода - известь перекачивается с целью ускорить выпадение в осадок хлористого магния.
Морская вода поступает на предприятие со скоростью около 1 млн. галлонов в час через подводные шлюзовые ворота канала, соединенного с Мексиканским заливом. Преимущество такой системы снабжения состоит в том, что нижние слои воды обладают значительно более высокой соленостью, чем поверхностные воды в районе завода. В искусственном бассейне вода непрерывно обрабатывается известковым молоком (выше упоминалось, что известь получают путем прокаливания устричных раковин). В результате реакции известкового молока с соединениями магния образуется жидкий илоподобный осадок нерастворимой гидроокиси магния, который затем перекачивается в отстойники. Осадок составляет примерно 2% общего объема морской воды, расходуемого в этом производстве, иными словами, уже на первой стадии технологического процесса осуществляется 100-кратное концентрирование полезного компонента. Отработанные воды спускаются в реку Брасос, впадающую в Мексиканский залив на значительном удалении от завода.
Отфильтрованную гидроокись магния растворяют в соляной кислоте. Полученный раствор хлорида магния концентрируют выпариванием, для того чтобы частично избавиться от захваченных из морской воды солей. Кальций осаждается в виде нерастворимого сульфата или гипса добавлением к раствору сульфата магния, после этого раствор снова фильтруют, чтобы отделить гипс и другие соли, и затем концентрируют выпариванием. Когда концентрация хлорида магния достигнет примерно 50%, а температура раствора поднимется приблизительно до 170°, его распыляют на предварительно высушенный твердый MgCl2. Растворитель мгновенно превращается в пар, а хлорид магния при этом осаждается. Высушенный твердый осадок затем помещают в электролитическую камеру, где он разлагается до металлического магния и газообразного хлора. Хлор преобразуется в соляную кислоту, которую успешно используют в последующих циклах процесса. Металлический магний отчерпывается из электролитической камеры и формируется в виде болванок. Содержание металла в них превышает 99,8% (Shigley, 1951).
Общая потребность США в сыром, первичном металлическом магнии уже со времени конца второй мировой войны удовлетворялась за счет производства его из морской воды. Во время войны правительство США построило ряд заводов, которые использовали в качестве сырья для производства магния магнезит, доломит, откачиваемые из скважин рассолы и морскую воду. Однако к концу войны ни один из этих заводов не мог выдержать конкуренции с предприятиями, извлекающими магний из морской воды, и это несмотря на то, что первым заводам правительство гарантировало полный сбыт продукции, тогда как предприятия, работавшие на морской воде, таких гарантий не имели.
Выбор участка для постройки магниевого завода определяется не столь жесткими требованиями, нежели завода, получающего бром из морской воды. Исключение, правда, составляет тот случай, когда извлечения брома и магния производятся совместно. Так, в процессе экстрагирования магния температура морской воды не имеет серьезного значения, менее важен и расход сырья: на производство 1 фунта элементарного магния расходуется всего лишь 5% тех количеств морской воды, которые используются при экстракции брома. Самыми важными факторами, диктующими целесообразность выбора места для завода, являются близость источников дешевой извести, топлива и электроэнергии. Эффективность процесса извлечения магния из морской воды составляет 85-90%. И хотя современные технологические возможности позволяют значительно полнее экстрагировать магний из морской воды, экономически это невыгодно, так как подсчитано, что увеличение коэффициента извлечения более 90% сопровождается резким возрастанием капитальных затрат на каждый процент прироста.
Одно из достоинств, присущих рассматриваемому процессу, состоит в том, что низкая стоимость сырья может быть еще более уменьшена, если эти материалы подавать непосредственно в технологическую линию путем их перекачки. Такая механизированная подача позволяет сделать производственный процесс в значительной мере непрерывным и установить приборы автоматического контроля. Кроме того, положительная особенность завода такого типа состоит в чрезвычайном единообразии потребляемого им сырья.
Магниевые соединения
Магний в форме MgO, Mg(OH)2 и MgCl2 находит широкое применение в самых различных областях промышленности. Его используют как огнеупорный материал для внутренних покрытий в плавильных печах, как сырье для фармацевтического производства, в изоляторах, при производстве удобрений, искусственного шелка и бумаги и многого другого. Многие компании мира получают соединения магния из морской воды; в частности это характерно для Англии и США. Впервые промышленное извлечение магниевых соединений из морской воды проводилось как побочный процесс из остаточных рассолов при получении поваренной соли (Seaton, 1931; Manning 1936, 1938).
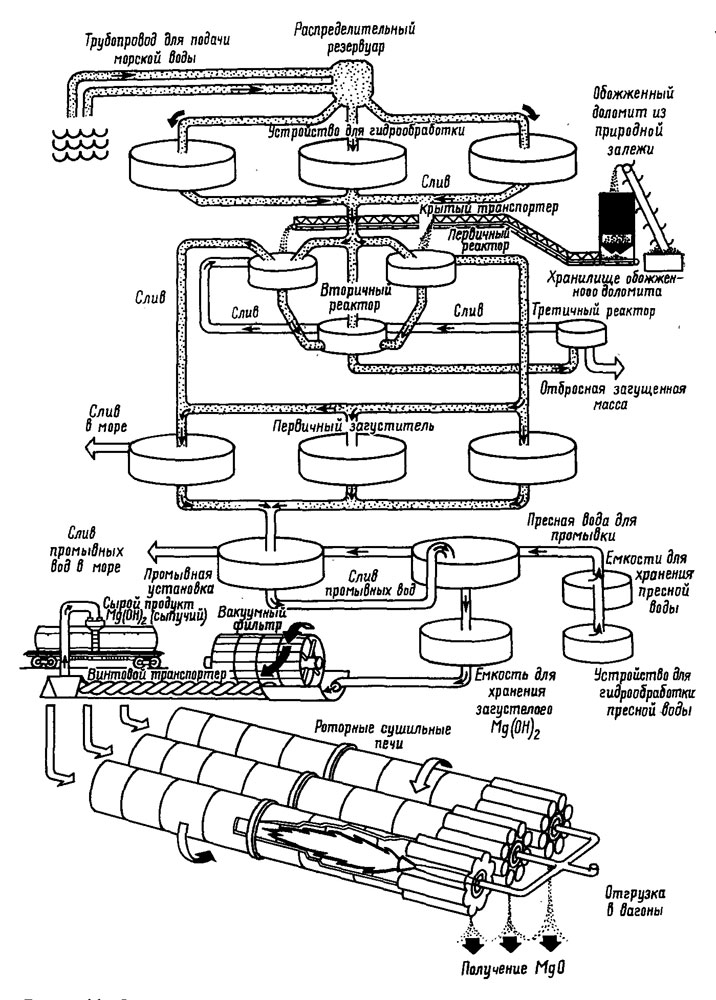
Рис. 11. Последовательность процесса на магниевом заводе компании 'Кайзер алуминум эид кемикл' близ Мосс-Лендинга (Калифорния).
Схема процесса извлечения магниевых соединений из морской воды изображена на рис. 11. Такую технологическую схему применяют на своих предприятиях компании "Кайзер алуминум энд кемикл корпорейшн" близ Мосс-Лендинга (Калифорния). Морская вода смешивается с прокаленным доломитом. Происходит осаждение гидроокиси магния, которая затем отстаивается в больших концентрационных емкостях. После отстаивания гидроокись магния извлекается, промывается для удаления растворимых примесей и фильтруется с целью уменьшить содержание воды примерно до 50%. Часть полученной таким образом гидроокиси магния поступает в продажу в виде гомогенизированного осадка на фильтре, оформленного как брикеты. Эта продукция используется при производстве бумаги и магнезиальной изоляции. Оставшаяся на фильтре часть осадка затем вновь прокаливается до образования различных сортов MgO, которые могут быть использованы при получении искусственного шелка, резины, изоляционных покрытий, огнеупорных кирпичей. На рис. 12 показан завод компании "Кайзер" по производству магниевых соединений.

Рис. 12. Завод по извлечению магния из морской воды компании 'Кайзер алуминум энд кемикл' близ Мосс-Леидинга (Калифорния) (снимок с самолета).
В США около 90% всего объема каустической кальцинированной окиси магния и около 50% огнеупорной магнезии получают из морской воды либо из рассолов, выкачиваемых из скважин.
Золото из морской воды
На разработку методов извлечения золота из морской воды потрачено так много сил и средств, что в этом отношении с ним трудно сравнивать какой-либо другой элемент. По вопросам, связанным с экстракцией золота из морской воды, было выдано много патентов, касающихся как самих методов, так и оборудования (Bardt, 1927; Baudin, 1916; Bauer, 1912; Cernik, 1926; Bitter, 1938; Stoces, 1925). В 1866 г. один из членов Французской Академии наук обнаружил присутствие ничтожных количеств золота в морской воде. А позднее, в 1886 г., было сообщено, что содержание золота в водах Ла-Манша составляет до 65 мг на 1 т воды.
В начале этого столетия Сванте Аррениус указал, что прежние определения содержания золота в морской воде были преувеличены, по крайней мере, в 10 раз. Но, тем не менее, расчеты самого Аррениуса показали, что минимальное содержание золота в морской воде не ниже 6 мг на 1 т. По этим расчетам, в Мировом океане заключено примерно 8 млрд. т золота. Такого количества золота вполне достаточно, чтобы сделать каждого человека на земле миллионером. Но, несмотря на многочисленные патенты и проекты, до сих пор из морской воды не получено еще никаких практически ощутимых количеств этого металла.
В конце первой мировой войны блестящий немецкий химик, лауреат Нобелевской премии доктор Фриц Хабер утверждал, что военный долг Германии можно оплатить золотом, извлеченным из моря. Считая, что концентрация золота составляет 5-10 мг на 1 т морской воды, Хабер укомплектовал исследовательское судно соответствующим персоналом и оборудованием для изучения наиболее высоких содержаний золота в океанах. Однако к своему большому огорчению, Хабер установил, что концентрации золота редко превышают 0,001 мг на 1 т воды (Haber, 1927). Самое высокое содержание золота отмечается в Южной Атлантике и составляет 0,044 мг на 1 т. Даже в заливе Сан-Франциско, куда впадают реки, дренирующие золотоносные районы, концентрация золота не намного превосходит среднее содержание этого элемента в открытом океане. После 10 лет, посвященных работе над этой проблемой, Хабер пришел к заключению, что извлечение золота из морской воды невыгодно. В настоящее время установлено, что полученные Хабером значения содержаний золота в морской воде являются несколько неточными, поскольку он не учитывал, очевидно, присутствия золота в химикалиях и в реакционных сосудах, которыми он пользовался во время анализов.
Методы экстракции золота из морской воды основаны на использовании сульфидных частиц, которые обладают большим сродством к золоту. При прохождении морской воды над этими частицами золото, как полагают, прилипает к поверхности сульфидов. Кроме того, в качестве материала для извлечения золота из морской воды предлагалась также ртуть.
Несмотря на множество попыток экстрагировать золото из морской воды, известен всего лишь один случай, когда были получены сколь-либо ощутимые количества этого металла. В связи с широко развернутыми работами на заводе по извлечению брома в Северной Каролине "Этил дау кемикл компани" проводила исследование возможностей экстракции других металлов, включая золото. В результате переработки 15 т морской воды удалось извлечь 0,09 мг золота, стоимость которого составляет примерно 0,0001 долл. На сегодня это ничтожное количество составляет все то золото, которое было извлечено из морской воды (Terry, 1964).
Другие вещества, извлекаемые из морской воды
Помимо обычной соли, брома, магния и его соединений, из морской воды иногда извлекается ряд других веществ. Они, как правило, являются побочными продуктами при производстве соли либо их получают через промежуточное посредничество некоторых растений или рыб.
Впервые йод был обнаружен в золе водорослей в 1811 г. французом Бернаром Куртуа, владельцем фабрики по производству селитры. В поисках подходящего сырья для получения щелочи он решил использовать для этой цели водоросли. Очищая реакционные сосуды, в которых находилась горячая концентрированная серная кислота, он обратил внимание на выделения испарений фиолетового цвета, из золы водорослей. Пары конденсировались на стенках более охлажденной части сосуда в виде темных металлоподобных кристаллов (Armstrong, Miall, 1946). Содержание йода в некоторых водорослях, в частности в Laminaria, оказалось равным примерно 0,5% в пересчете на воздушно-сухую основу. Концентрация же йода в морской воде равна приблизительно 0,05 мг/л, или около 0,000005%. Таким образом, в указанных видах водорослей происходит 100000-кратное концентрирование йода в сравнении с его содержанием в морской воде.
Вскоре после открытия Куртуа было установлено значение йода для медицины. Началось интенсивное развитие промышленности, главным образом в Северной Англии, по извлечению йода из морских водорослей. В 1846 г. в Глазго функционировало более 12 фабрик, экстрагирующих йод из морских водорослей. Однако обнаружение йода в чилийских залежах нитратов привело к упадку добычи йода из морских водорослей.
Примерно в то же время из морских водорослей извлекались значительные количества калиевых и натриевых солей. Технология этого процесса, по существу, была не разработана. Обычно проводилось простое выщелачивание водорослей водой и последующее выпаривание полученного раствора. Другой весьма распространенный метод получения солей состоял в том, что водоросли сжигались, а зола выщелачивалась водой. В результате этих примитивных процессов йод получался в виде соединений - йодидов калия либо натрия, которые при смешивании их с серной кислотой и двуокисью марганца восстанавливались до элементарного йода.
В истории использования водорослей выделяются три различных периода: а) первый - когда водоросли применялись как сырье для получения щелочи, б) второй - когда их использовали для извлечения йода и в) третий - когда из водорослей добывали поташ. Однако каждый из периодов заканчивался созданием более совершенных методов получения этих продуктов из более дешевого сырья, добываемого на суше. В настоящее время водоросли используются как сырье для получения натриевого альгината - органического соединения, применяемого в качестве желатинообразующего и эмульсиообразующего агентов при производстве продуктов питания. Крупные предприятия, перерабатывающие морские водоросли в качестве сырья для производства рассматриваемых химических соединений, размещены на побережье Южной Калифорнии. Во многих частях света, особенно на Востоке, водоросли широко используются как продукты питания. В некоторых приморских странах их применяют в качестве удобрений.
Добыча минеральных соединений при опреснении морских вод
В последние годы уделяется особое внимание проблеме опреснения морских вод. Как правило, концентрация солей в сбросных водах в этом случае во много раз превышает содержание этих солей в исходной морской воде. В ходе работ по извлечению минеральных соединений из таких рассолов получены весьма обнадеживающие результаты. Это относится к снижению расходов по перекачиванию вод, поступающих на перерабатывающий завод с относительно высокой температурой рассола и примерно в 4 раза повышенной концентрацией.
Если процесс опреснения морской воды окажется рентабельным, то количество минеральных соединений, которые можно было бы извлекать из сбросных вод, во много раз превысит ожидаемые потребности. Допустим, например, что в ближайшие несколько десятков лет население прибрежных областей достигнет примерно 100 млн. человек, которые будут ежегодно расходовать для бытовых и промышленных целей в среднем по 100 тыс. галлонов воды на душу населения. Такой темп потребления в конечном итоге может достичь величины примерно 1013 галлонов, или 10 куб. миль, воды в год. При поступлении этого объема воды из океана и эффективности извлечения пресной воды 25% через перерабатывающие опреснительные заводы будут проходить 6,4 млрд. т хлорида натрия, 240 млн. т магния, 160 млн. т серы, 800 тыс. т бора, 2 тыс. т алюминия, 400 т марганца, 560 т меди, 560 т урана, 2 тыс. т молибдена, 40 т серебра и около 1 т золота. Будем считать, что экономически выгодно добывать лишь 10% этих количеств и что население, для которого проводилось опреснение морской воды, способно потреблять эти минеральные компоненты. Тогда, основываясь на статистических данных, помещенных в табл. 3, можно сделать вывод, что темпы извлечения молибдена, бора и брома будут соответствовать их потреблению, в то время как производство других минеральных соединений будет значительно превышать потребность в этих веществах. Разумеется, нет никакой необходимости в извлечении всех солей. Целесообразно получать лишь те соли, которые пользуются сбытом. Во всяком случае, в связи с техническими трудностями маловероятно, чтобы в настоящее время проводилось промышленное извлечение какого-либо элемента, концентрация которого в морской воде ниже, чем бора. Заслуживают внимания, однако, следующие соображения. Если удалось бы извлечь из морской воды уран и торий, то использование этих элементов в реакторах бридерного типа дало бы тепловую энергию, необходимую для работы конверсионных заводов по производству пресной воды.
| Элемент | Годовая продукция, т |
Производство на душу населения при общей его численности 108 человек, т/год |
Современное потребление в США на душу населения, т/год |
Отношение производства к потреблению |
| NaCl | 64*108 | 64 | 0,145 | 440 |
| Магний | 2,4*108 | 2,4 | 25*10-4 | 10000 |
| Сера | 1,6*108 | 1,6 | 0,033 | 50 |
| Калий | 68*106 | 0,68 | 0,010 | 68 |
| Бром | 1,2*106 | 0,012 | 4,7*10-4 | 25 |
| Бор | 0,8*106 | 0,008 | 5,5*10-4 | 15 |
| Алюминий | 2000 | 2*10-5 | 0,013 | 0,001 |
| Марганец | 400 | 4*10-6 | 0,0033 | 0,001 |
| Медь | 560 | 7*10-6 | 0,0067 | 0,001 |
| Уран | 560 | 5*10-6 | 1,4*10-4 | 0,04 |
| Молибден | 2000 | 2*10-5 | 8,3*10-5 | 24 |
| Серебро | 40 | 6*10-7 | 3,0*10-5 | 0,02 |
| Никель | 400 | 4*10-6 | 0,001 | 0,004 |
| Золото | 1 | 2*10-9 | 5,0*10-6 | 0,0004 |
В настоящее время сконструированы крупные ядерные реакторы, которые могли бы обеспечить тепловой и электрической энергией конверсионные опреснительные установки (Hammond, 1962) Подсчитано, что стоимость производства пресной воды составляет примерно 0,15 долл. за 1000 галлонов, что успешно выдерживает сравнение со стоимостью воды, потребляемой в городском хозяйстве или для ирригационных целей в некоторых районах. Крупный завод с реакторной установкой может производить ежедневно около 109 галлонов пресной воды; этого количества должно хватить для удовлетворения бытовых и хозяйственных нужд города с 4-миллионным населением либо для орошения посевов площадью 500 кв. миль. Трудно ожидать, однако, чтобы такие заводы стали в ближайшие несколько десятков лет серьезными источниками снабжения пресной водой. Недостаточно аргументированным является также и предположение о будущем потреблении минеральных компонентов морской воды и о характере изменения цен и других расходов. Иными словами, статистические выкладки, помещенные в табл. 3, представляют лишь теоретическую ценность.
|
ПОИСК:
|
© UNDERWATER.SU, 2001-2019
При использовании материалов проекта активная ссылка обязательна:
http://underwater.su/ 'Человек и подводный мир'
При использовании материалов проекта активная ссылка обязательна:
http://underwater.su/ 'Человек и подводный мир'